



2型糖尿病综合管理流程
血脂异常的治疗(流程图4)是DM和糖尿病前期管理的重要组成部分。
胰岛素缺乏
胰岛素抵抗
这会导致特别是致动脉粥样硬化状态,其特征是含载脂蛋白B(apo B)——颗粒水平增加,包括富含甘油三酯(TG)的极低密度脂蛋白(VLDL)、中密度脂蛋白和残余颗粒,导致低水平的高密度脂蛋白胆固醇(HDL-C)和高水平的小而密的低密度脂蛋白胆固醇(LDL-C)。空腹血脂检测对于治疗决策不是必需的,非空腹血脂检测可以帮助改善患者依从性及时采血。
有关血脂异常管理的其他详细指南,请参阅2017年AACE血脂异常管理和心血管疾病预防指南,以及2020血脂异常管理与心血管疾病预防流程。
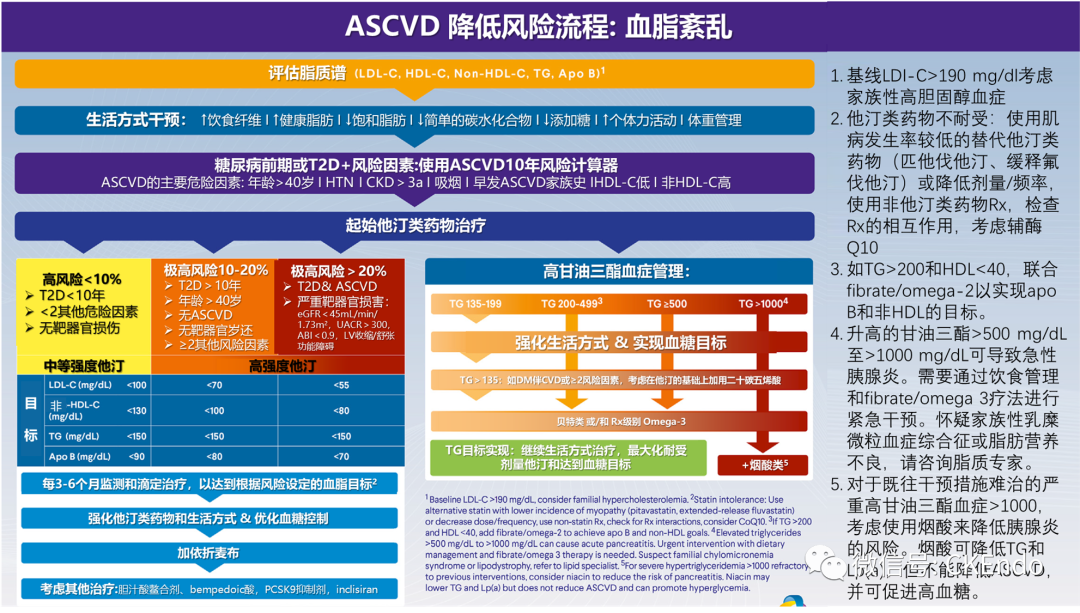
第一步. 首次就诊或诊断时评估脂质组
所有患有糖尿病前期或T2D的成年人在诊断时和每年都应通过脂质小组进行筛查,以评估ASCVD风险。
标准血脂检测包括:
总胆固醇
TG水平
HDL-C
血脂异常的继发原因应排除。可能有促成的潜在疾病或药物,进行干预(如果医学上合适)可能改善或解决异常。评估应从病史、家族史和营养史开始。查看所有药物、非处方药和补充剂。甲状腺、肾功能和肝功能的实验室检测可能会暴露继发原因。基线LDL-C >190 mg/dL的患者应进行家族性高胆固醇血症调查。由于TG水平极高,有可能诊断为家族性乳糜微粒血症综合征。对于这两种疾病,建议转诊至脂质专家进行评估和管理。
血脂异常的其他继发性原因包括身体状况,如超重或肥胖、高血糖、甲状腺功能减退、妊娠、CKD≥3期(特别是伴有蛋白尿)、肾病综合征、胆汁淤积性疾病、脂肪营养不良、副蛋白血症(如丙种球蛋白血症、多发性骨髓瘤)和慢性炎性疾病(如类风湿性关节炎、系统性红斑狼疮)。
可导致或加重血脂异常的药物包括口服雌激素和孕激素、合成代谢类固醇、选择性雌激素受体调节剂、高效抗逆转录病毒疗法(如用于治疗HIV的蛋白酶抑制剂)、免疫抑制药物(如环孢菌素、雷帕霉素激酶抑制剂的哺乳动物靶点)、糖皮质激素、类视黄醇、干扰素、紫杉醇衍生物、左旋门冬酰胺酶、环磷酰胺、非典型抗精神病药物、β-阻断剂和噻嗪类利尿剂。虽然胆汁酸螯合剂可以降低胆固醇,但这些药物也可能增加TG水平,在TG水平升高的患者中应谨慎使用。此外,TG水平和LDL-C水平可能随着血糖控制的改善而改变,因此在考虑添加或滴定抗血脂药治疗时,必须考虑起始降糖药物治疗的影响。
建议进行辅助apo B测定,以评估标准脂质组未显示的残余和小密度脂蛋白引起的残余ASCVD风险。Apo B在预测ASCVD风险方面优于LDL-C,且比非HDL-C更准确。还有其他生物标志物,包括高敏C反应蛋白、脂蛋白(a) (Lp[a]),冠状动脉钙评分、和踝臂指数(ABI)与ASCVD事件风险增加独立相关,且在脂质管理目标不明确时可能有所帮助。当开始或加强治疗的决定不确定时,例如对于糖尿病前期患者和没有既往CV事件的患者,风险计算器也有助于估计ASCVD的10年风险(表1)。
表1 ASCVD 10年期风险计算器

第二步. 启动生活方式干预
血脂异常最常见的继发原因是碳水化合物和/或单糖含量高的饮食加上久坐的生活方式。过度饮酒也会导致血脂异常,尤其是高甘油三酯血症;应鼓励尽量减少饮酒。如果超重/肥胖,应向血脂异常者提供工具,通过剥夺热量促进体重减轻。体重减轻≥5%可改善TG水平,即使体重减轻> 15%,仍可观察到TG水平持续进一步下降。生活方式干预方面的咨询很重要,应包括健康饮食方面的建议(全食、植物性、地中海式和DASH饮食);避免加工食品、饱和脂肪、简单碳水化合物、白色淀粉和添加糖;和增加的膳食纤维(30-40g/天)和瘦蛋白质(例如,鱼、瘦肉和无皮家禽)的摄入。运动方案应包括每周至少150分钟的中等强度活动,分为每周3至5次,以及每周≥2次的阻力训练。
高龄、
HTN、
CKD分期≥3、
吸烟、
男性< 55岁、女性< 65岁的ASCVD早发家族史、
评估患者的风险类别有助于确定脂质治疗目标和指导适当的降脂治疗。可将糖尿病前期或T2D患者分类,以设定如下治疗目标:
高风险(< 10% 10年期风险):T2D持续时间< 10年伴< 2个其他传统ASCVD风险因素且无靶器官损害
目标:LDL-C <100 mg/dL,apo B <90 mg/dL,非-HDL-C < 130mg/dL
极高风险(10%-20% 10年期风险):T2D >10年,传统ASCVD风险因素≥2,无靶器官损害
目标:LDL-C <70 mg/dL,apo B <80 mg/dL,非HDL-C <100 mg/dL
极端风险(> 20% 10年风险):T2D或糖尿病前期加上已确定的ASCVD或靶器官损害(左心室[LV]收缩或舒张功能障碍,估计肾小球滤过率[eGFR] <45 mL/min/1.73 m2,或ABI <0.9)
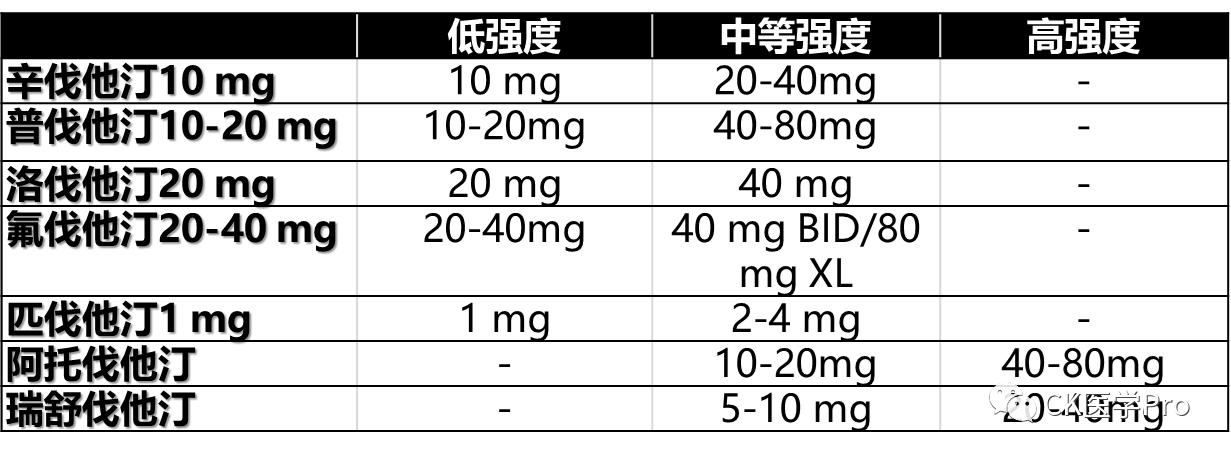
除非禁用,否则应使用他汀类药物作为T2D患者血脂异常的一线治疗。高危患者(10年风险< 10%的T2D患者)应开始中等强度的他汀类药物治疗,这可使LDL-C减少30%至40%(表2)。对于糖尿病前期患者,应根据其ASCVD风险评分和使用他汀类药物进展至T2D的轻微风险来权衡他汀类药物治疗的获益。90,对于风险非常高(10%-20% 10年期风险)和极端风险(> 20% 10年期风险)的患者,应开始高强度他汀类药物治疗,将LDL-C降低50%至60%,与基线LDL-C水平无关(表2)。即使使用最大耐受他汀类药物治疗,具有多种风险因素的患者和临床表现稳定的ASCVD患者仍可能存在残余风险。最初应每隔6至12周监测一次血脂,以确定是否需要加强治疗,然后在达到目标后,每隔更短的时间(如6个月)监测一次。
表2 他汀类药物治疗强度
部分患者可能表现出他汀类药物不耐受。他汀类药物相关肌肉症状(SAMS)的特征是与开始使用他汀类药物相关的双侧肌肉症状——疼痛、无力、痉挛和僵硬,但因果关系并不总是明确的。他汀类药物不耐受的发生率在5%至20%之间,在安慰剂对照试验中发生率较低;直接询问肌肉症状的临床试验没有显示他汀类药物组和安慰剂组之间的肌肉症状率的显著差异。当再次接受相同或替代他汀类药物治疗时,SAMS可能会随停药而消退并复发。管理包括确认患者的症状并考虑增加肌酸激酶(CK)。FDA认可的他汀类药物诱导的肌病定义为疼痛或无力伴有CK水平>正常实验室检测范围上限的10倍,但这种情况很罕见(超过安慰剂< 0.1%)。CK >40倍正常上限的严重横纹肌溶解症的风险,约为每年1至4万分之一。
年龄> 65岁、
女性、
低BMI、
东亚血统、
肌肉症状史、
肾功能和/或肝功能损害、
DM、
HIV感染、
合用药物(如贝特类、红霉素、氟康唑)、
维生素D缺乏、
甲状腺功能减退
应考虑药物相互作用,特别是对于首过代谢高且通过CYP3A4代谢的合用药物和他汀类药物(如辛伐他汀、洛伐他汀)。当症状消退且肌病不严重时,使用较低剂量或较低频率给药(每周1-3次)进行再挑战,或使用与肌病相关性较小的亲水性他汀类药物(如匹伐他汀、氟伐他汀)可能允许继续他汀治疗。尽管观察性研究显示25-羟基-维生素D3水平的正常化可能有助于他汀类药物诱导的肌病,维生素D和ω-3试验(VITAL/ the VITamin D and OmegA-3 Trial)的二次分析表明,与安慰剂相比,补充维生素D不会使他汀类药物诱导的肌病发生率不同。但可考虑补充辅酶Q10。
在T2D患者中,应定期(每6-12周)进行额外的血脂水平实验室检测,以直接滴定他汀类药物或增加辅助治疗,从而实现血脂目标;一旦脂质目标持续实现,可以考虑延长检测间隔。如果最大耐受他汀类药物治疗不能达到脂质目标,则应考虑添加胆固醇吸收抑制剂依折麦布(10mg/天)。如果他汀类药物联合依折麦布的最大耐受量未达到治疗目标,则可选择使用胆汁酸螯合剂(colesevelam/考来维仑、colestipol/考来替泊、消胆胺)或贝派地酸(bempedoic acid/三磷酸腺苷-柠檬酸裂解酶抑制剂)进行额外治疗。在最大高强度他汀类药物联合上述附加治疗,血脂值仍高于目标值的极端风险患者中,可能需要使用前蛋白转化酶枯草杆菌蛋白酶/可欣9型抑制剂(PCSK9i)或inclisiran (PCSK9 siRNA)进行更积极的治疗,同时考虑已批准的适应症和途径。
高甘油三酯血症的管理< 150 mg/dL对于T2D患者达到最佳血脂水平也很重要。如果需要,吡格列酮和/或胰岛素可以改善血糖控制和TG水平。尽管有最大耐受量的他汀类药物,空腹TG水平仍> 200 mg/dL的人群中,优化葡萄糖控制、严格遵守健康饮食(如避免简单的碳水化合物、果汁和酒精)、非诺贝特和/或高剂量处方级ω-3脂肪酸可能有助于达到TG水平和非HDL-C的目标。非处方药鱼油补充剂未被FDA批准用于高甘油三酯血症。尽管有最大耐受他汀类药物,空腹TG水平仍> 200 mg/dL的人群中,最佳的葡萄糖控制、严格遵守健康饮食、非诺贝特和/或高剂量处方级ω-3脂肪酸可能有助于达到TG水平和非HDL-C的目标。然而,在最佳剂量他汀类药物的背景下,对于TG水平> 200-500 mg/dL,通过添加贝特类药物降低CV风险尚未明确确定。在通过降低糖尿病患者甘油三酯降低心血管结局的Pemafibrate (PROMINENT)试验中, T2D伴TG水平> 200mg,使用Pemafibrate后,尽管TG、VLDL、残余胆固醇和Apo C-III水平有所降低,但并未降低的CV事件发生率。98然而,贝特类药物试验的亚组分析和荟萃分析显示,在TG水平升高(> 200 mg/dL)和/或HDL-C (<40 mg/dL)的患者中,ASCVD结果有所改善。
使Icosapent Ethyl(二十碳五烯酸乙酯)减少心血管事件干预试验(REDUCE-IT)表明,在TG水平> 135 mg/dL伴ASCVD或年龄> 50岁且有第二个CV风险因素的T2D受试者中,将Icosapent Ethyl (IPE)联合到他汀类药物治疗中可将CVD事件积极减少25%,但这种影响与TG水平降低无关。102有人对在REDUCE-IT中使用矿物油安慰剂时IPE的有益作用大小表示了潜在的担忧,但总体而言,如果T2D患者伴已确定患有ASCVD或≥2的其他传统CVD风险因素患者的TG水平> 135 mg/dL,则应考虑IPE。
对于严重的高甘油三酯血症(TG水平≥1000 mg/dL),除贝特类药物和/或处方ω-3脂肪酸外,可能需要极低脂肪饮食。对于难治性病例,如果空腹TG水平仍> 1000 mg/dL,则可能需要烟酸来降低TG水平并降低胰腺炎的风险。值得注意的是,烟酸可能降低TG水平和Lp(a),但不会降低ASCVD,并可能加重血糖紊乱。
内分泌代谢病疾病 @CK医学
内分泌代谢病知识架构 @CK医学
内分泌代谢病分级诊疗 @CK医学