



摘要
空气栓塞是外科手术中罕见但可能致命的并发症。快速诊断和治疗对于降低发病率和死亡率至关重要。回顾分析一个三级医疗中心的医疗过程中的空气栓塞经验,对25年期间所有空气栓塞病例进行了电子医疗记录搜索;审查了相关的医疗和成像记录。查明67例空气栓塞病例;平均年龄为59岁(范围:3-89岁)。95%发生在医院,其中77.8%发生在手术/侵入治疗过程中,血管介入相关操作(33%)最常见。临床症状和体征与气栓的位置有关;36例右心/肺动脉,其中大脑21例,卵圆孔未闭10例。21%患者接受高压氧治疗,7.5%的患者吸入空气,63%的患者没有后遗症。死亡率为21%,69%在48小时内死亡。13名心脏骤停患者(13.5%)死亡率为53.8%。
1.引言
医源性手术是导致血管性空气栓塞(VAE)的主要原因。这种罕见的并发症可出现在广泛的临床场景中,包括留置管放置、创伤、气压损伤和外科手术,包括心脏、血管和神经外科。传统上,手术和创伤是全身和脑空气栓塞的最重要原因;然而,内镜、血管造影、组织活检、胸腔穿刺、血液透析和中心/外周静脉通路现在占更大比例[1-3]。先进血管通路装置的插入和维护越来越多地在多个临床专业范围内进行。此外,大多数介入放射学(IR)手术都是从放置血管内鞘开始的,这是整个手术过程中空气栓塞的主要危险因素。血管内手术并发血管内空气栓塞导致明显的发病率和死亡率。血管性空气栓塞是一种潜在的可预防疾病,其产生是因为压力梯度使空气进入血流,从而导致血流堵塞。根据一个系列的估计,血管性空气栓塞的发病率为1/772,而另一项研究发现,医源性气体栓塞的发病率使每100000人中有2.65人住院;这些数字被认为低于实际发病率,因为还有许多未报告的病例和未确诊的无症状患者[4-6]。在本文中,我们将回顾三级医疗中心所有的空气栓塞病例,包括原因分析,临床征象和症状,治疗和预后。
2.材料和方法
这一回顾性的单中心研究获得了机构审查委员会的批准。在25年的时间里,使用ICD-9-CM空气栓塞代码,对所有空气栓塞病例进行了电子医疗记录搜索;此外,在同一时期,还搜索了一个单独的放射学报告数据库,以寻找“空气栓塞”相关术语。对登记册数据进行了检索和合并,随后对相关的医疗和成像记录进行了审查。发现有影像学证据或临床怀疑空气栓塞的患者。包括突然出现的低氧血症,呼末二氧化碳下降,急性心肺损害引起心肺骤停或需要血管加压药物,并有运动或感觉的变化,或出现癫痫。此外,所有患者都需要有一个明确前兆事件,包括开放式、腹腔镜式或血管内手术、中心或周围放置或移除静脉导管,或环境原因,如潜水(自我水下呼吸器)。记录和分析了各种变量,包括事件发生的地点、直接的迹象/症状、出院时的结果以及所用的治疗方法。使用Fisher’s的精确测试进行统计分析,以评估不同患者组之间的差异。
3.结果
在研究期间,有67位患者被确诊为空气栓塞:34位男性患者和33位女性患者,平均年龄59岁(3-89岁)。大多数事件(94%,n=63)发生在医院内,有四个病例发生在社区( 表1)。在医院内发生的病例中,最常见的是在外科手术期间(77.8%,n=49),包括介入放射学(IR)。在这49例中,33例发生在手术室,9例发生在IR,4例发生在心脏导管室,2例发生在内窥镜室,1例发生在围手术期。在社区中发生的这四个案例中,一个与水肺和接近溺水有关,另一个与潜水有关。
表1.导致空气栓塞的事件的地方
发生事件地点 | 例数 |
社区 | 4 |
血透室 | 2 |
ICU | 11 |
术中(包括介入放射学) | 48 |
围手术期 | 1 |
放射学(不包括介入放射学) | 1 |
术中病例包括各种各样的手术,从血管通路到开放性神经外科手术(表2)。最常见的与空气栓塞有关的操作是中央血管通道(n=9)及开放式神经外科手术(n=11)。血管通路病例中,有四个发生在放置透析管时,两个发生在放置胸腔闭式引流管时。在开放性神经外科病例中,6例发生在创伤和/或急性颅内出血后的急诊过程中,5例发生在选择性手术中。34%(n=23)在影像学研究中,有死前空气栓塞的证据。
表2.空气栓塞与手术操作关系
操作 | 例数 |
腹主动脉瘤修补术 | 1 |
腹会阴切除术 | 1 |
试验性间隔缺损闭合术 | 2 |
支气管镜 | 1 |
冠状动脉旁路移植术 | 2 |
心脏消融术 | 1 |
心导管插入术 | 3 |
经静脉注射 | 1 |
中心血管通路 | 9 |
内窥镜逆行胆胰造影术(ERCP) | 1 |
膀胱镜 | 1 |
腹腔镜肝切除术 | 2 |
非肠道切除术 | 1 |
起搏器放置 | 1 |
血管内神经干预 | 2 |
神经外科(开放手术) | 11 |
脊柱手术 | 3 |
经动脉化疗栓塞(TACE) | 1 |
心脏瓣膜置换术 | 4 |
静脉曲张静脉注射 | 2 |
包括所有手术在内,与血管相关的操作过程空气栓塞最多见。除了上述9例与静脉留置导管放置有关的病例外,还发现13例发生在使用或移除血管通道(图1;表3),包括两例不小心通过静脉注射静脉注射给药。
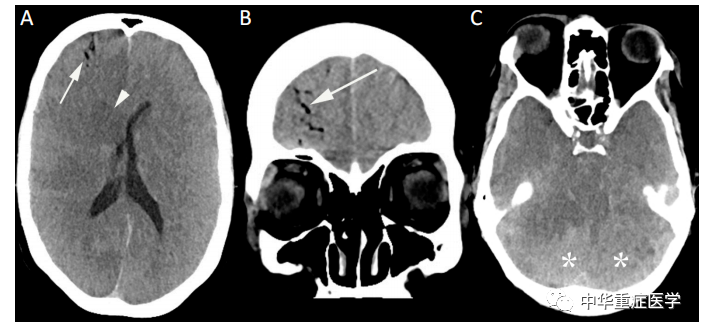
图1.这张照片显示的是一名50岁女性在医疗监护病房的头颅CT,颈静脉导管拔除后出现。头颅CT(A–C)显示右侧额叶内气体分布,提示血管内位置(箭头、A和B),并伴有弥漫性灰质分化丧失,最显著的是中央深核(箭头)。有证据表明存在水肿效应,基底池(C)消失,小脑征(*)肿胀。
表3.与使用、放置或移除外周或中央静脉通道有关的空气栓塞病例
中央血管通路 | 例数 | 总数 |
髋关节手术前中心静脉放置 | 1 | 9 |
透析导管放置 | 4 | |
希克曼放置 | 1 | |
多创伤中心静脉导管放置 | 1 | |
输液港放置 | 2 | |
中心静脉导管移除 | ||
颈内中心静脉导管撤除 | 5 | 7 |
肺动脉导管撤除 | 1 | |
锁骨下中心静脉导管撤除 | 1 | |
其他导管相关 | ||
出院病人,并在家里撤除中心静脉导管 | 1 | 6 |
通过静脉通路装置意外吸入空气 | 2 | |
患者在家中撤除PICC | 1 | |
外围静脉导管放置 | 2 | |
右心或肺动脉空气栓塞36例,脑栓塞21例,其余病例涉及肢体或冠状动脉(表4)。有14例可疑的空气栓塞,从静脉系统通过右到左分流进入动脉系统,最常见的是卵圆孔未闭。13例与脑循环空气栓塞相关,1例涉及在中心静脉导管撤除时通过卵圆孔未闭的冠状动脉空气栓塞。除1例患者外,其余所有患者均进行了超声心动图检查,在77%的病例中发现了卵圆孔未闭(n=10)。
表4.空气栓塞的解剖学定位
解剖学位置 | 例数 |
冠状动脉 | 8 |
下肢 | 1 |
肺动脉/右心 | 36 |
脑血管 | 21 |
肺动脉/右心和大脑动脉 | 1 |
立即的临床体征和症状与空气栓塞的位置有关;例如,脑空气栓塞与包括虚弱和癫痫发作在内的神经系统体征有关(表5)。13例患者立即发生心脏骤停。在少数(15%,n = 10)的病例中,患者被发现完全无症状,尽管有明显的既往事件和影像学或临床证据显示血管内空气。
表5.与空气栓塞相关的直接临床症状和体征
立即出现的临床症状/体征 | 例数 |
急性心肌梗死 | 1 |
心动过缓、低血压、无反应 | 1 |
心脏骤停 | 13 |
血氧饱和度下降 | 5 |
血氧饱和度下降和低血压 | 3 |
血氧饱和度下降和神经体征/症状 | 3 |
呼末二氧化碳下降(ETCO2) | 6 |
呼末二氧化碳下降(ETCO2)和低血压 | 6 |
神经系统体征/症状,无癫痫发作 | 16 |
在临床或影像学上未见异常 | 10 |
癫痫 | 3 |
空气栓塞的治疗包括14例高压氧治疗和2例体外膜氧合治疗。大多数患者(54%,n=46)在ICU接受治疗,虽然在许多情况下,这不一定只与空气栓塞有关,而是与相应的医疗条件有关。有5例患者无给氧,其中4名患者出院时无后遗症,另有1人死亡。
42名患者(63%)出院,无后遗症。在23位患有急性神经系统改变的病人中(表5),四例死亡,十例有后遗症,九例无后遗症(图2)。14人死亡,大多数患者(69%,n= 11)死于48小时之内(表6)。在14例死亡个案中,有9例是导致死亡的因素,包括严重的头部创伤(n=5),严重冠状动脉疾病(n=1,近期需要冠状动脉旁路移植术的急性心肌梗死n=1)肺脓肿/肺炎引起的呼吸衰竭(n=1),及严重缺氧性脑损伤(n= 1).
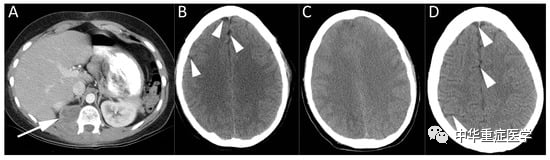
图2 20岁女性椎旁肿瘤增强CT (A);在切除这个恶性神经鞘肿瘤的脊柱手术中,出现严重的低血压,发现输液袋里有空气。B:正常大脑CT,显示大脑半球(箭头)周围的脑脊液(脑脊液)体积正常。在未来几天内进行的一系列脑部CT检查显示,脑水肿逐渐加重。C:第3天CT显示脑脊液消失和弥漫性脑肿胀。接受了高压氧治疗,并放置了颅内压监测器。19个月后进行脑CT检查,显示脑(D)外观基本正常,脑脊液间隙恢复正常(箭头)。患者从空气栓塞中恢复,但25个月后死于转移性疾病。
表6.与空气栓塞有关的病人死亡。
死亡时间 | 例数 |
24小时内 | 5 |
24~48小时 | 6 |
3~7天 | 2 |
超过7天 | 1 |
总死亡率为21%。心脏停搏初期的死亡率为53.8%,而非心脏停搏初期的死亡率为13.5%。这一差异在统计上是显著的(P= 0.0035).
4.讨论
如果没有足够的侧支供应,空气栓塞可能导致器官末梢缺血或梗死。空气栓塞对冠状动脉或脑循环可能产生重大的不利影响,即使是在空气体积较小的情况下。当空气进入静脉系统并最终导致肺循环阻塞时,会发生静脉气体栓塞。这可能是创伤或多种医源性手术造成的。解剖心脏缺陷--或在某些情况下,氧毒性和过多的气体--可能导致气泡通过肺血管。外气压与血管内中心静脉压之间的梯度特别是由于低血容量或在吸入过程中产生胸内负压而增加,从而增加了空气进入的可能性。在最多40%的患者中,CVP可能低于基准大气层[7],直立体位的病人或接受导管检查的病人,如血液透析导管的放置等。
相反,动脉气体栓塞(AGE)是在空气或气体进入动脉循环时形成的。这种类型的空气栓塞可以在空气直接注入动脉树(即血管造影)时形成,或者矛盾的是,通过室间隔缺损或卵圆孔未闭(PFO)形成。在我们的系列研究中,在77%的疑似矛盾空气栓塞进行超声心动图检查的病例中检测到PFO,而在一般人群中估计的发生率约为9%[8]。
所记录的临床体征和症状与空气滞留的机制和空气栓塞的位置有关。空气栓塞可能发生神经系统症状,这既是由于空气直接进入脑循环,也与循环衰竭导致的心排血量减少有关。年龄通常会明显地伴有一系列类似于中风的症状,包括局灶性神经功能缺陷、癫痫发作、意识丧失、意识不请、精神状态改变和瘫痪。一般来说,与严重空气栓塞相关的症状和体征是非特异性的。当呼吸困难、持续咳嗽、胸痛是主要的临床症状时,空气栓塞的诊断往往会被忽略。相应的临床体征包括发绀、缺氧、高碳酸血症、低血压、呼吸急促、气喘、支气管痉挛、心动过速或心动过缓[9]。肺水肿和由经肺通道或通过卵圆孔未闭从右至左分流引起的动脉空气栓塞可由静脉空气栓塞引起。少量的静脉空气栓塞通常被患者耐受和无症状,因为它们被肺毛细血管床过滤吸收。
血管内气体可引起动脉阻塞或内皮损伤、继发性血管痉挛和毛细血管渗漏。此外,根据个案报告,空气栓塞被认为是内皮细胞因子释放的原因,导致系统性炎症反应的发生[10]。
静脉空气栓塞的发病率和死亡率与气体量、积累率和空气栓塞发生时的位置有关。成年人的估计致死量空气约为200至300毫升(3至5毫升/千克)[1],这个量只要2-3秒,一个14针头,压力梯度为5cmH2O[11]。从本质上说,空气进入到右心脏的距离越近,产生致命后果所需的空气量就越少。
因此,许多涉及血管系统的开放式和经皮手术与潜在的空气栓塞风险有关。例如,如前所述,血管造影经常使用血管鞘来方便放置导管,为血管内空气的引入提供了一种可能的途径。这种风险也存在于开放式手术中;例如,在神经外科中,病人可能在直立位置上进行手术,导致硬脑膜静脉窦的低血压,估计空气栓塞的发生率在10%至80%之间[12,13]。动脉空气栓塞可能是由于空气直接注入动脉树(例如在血管造影期间),也可能是自相矛盾的,因为静脉性的空气栓塞已经通过未闭卵圆孔进入左心脏。
据我们所知,这是研究空气栓塞的所有原因的最大病例系列。这67个患者代表了一个不同的群体,具有各种潜在的医疗条件。然而,我们系列中的许多病人都经历了与空气栓塞风险有关的侵入性医疗操作,包括中央静脉导管的放置[14]及撤除[15],支气管镜检查:亚激光手术[16],连同神经外科[1,17]及心脏外科[18]。
当空气到达右心室或肺动脉时,有证据表明有不同程度的心肺损伤,从低血压到心血管衰竭。在许多处于麻醉状态的患者中,第一个临床上的改变被注意到的是呼末二氧化碳的突然下降[2](图3)。尽管血氧饱和度测定提供了血液氧合水平的细节,生命检测仪监测可以通过图形或数字来评估通气的有效性[2]。一般而言,空气栓塞呼末二氧化碳测量最为敏感的测量方法。在本组病例中,12例患者最初出现呼末二氧化碳下降。虽然在全麻病人中定期进行这种监测,但最近建议在使用中深镇静剂的情况下使用,特别是与介入放射学有关[19-21],特别要注意呼末二氧化碳监测。
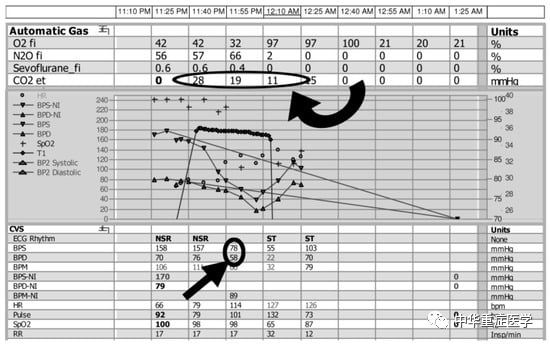
图3.呼末CO2的变化
一名76岁的妇女因外伤性颅内出血而接受半切除术,术中麻醉记录空气栓塞监测。头盖骨开放大约5分钟后,呼末二氧化碳突然下降(圈形,弯形箭头)后,收缩压和舒张压(圈形,直形箭头)均迅速下降。立即采取了措施,包括低下头,创口用生理盐水。不过,在呼末二氧化碳下降3分钟后,患者出现了无脉冲电活动(PEA)心脏停止活动,尽管采取了复苏措施,但在1小时后死亡。
除了支持性治疗,包括使用100%的氧气,当怀疑有空气栓塞时,立即治疗选择包括关闭大气和血管系统之间的任何导管。在我们的系列研究中,至少有5例病例尝试了抽吸。在静脉空气栓塞的情况下,杜兰特的操作可以进行[23];通过将患者放置在左侧卧位和特伦德伦堡位,这有助于鼓励气泡离开右心室流出道(RVOT)进入右心房,从而缓解导致潜在灾难性心肺崩溃的“气锁”效应。
高压氧治疗在空气栓塞治疗中起着重要作用。根据气体中压力和体积的关系,已经证明气泡的大小与大气压力成反比。例如,在六个大气压下,气泡的相对体积为大气压力时的17%[24]。在我们的组群中,14位患者接受高压氧治疗(HAT),死亡率为14.3%,而在未接受HAT治疗的组中,死亡患者的死亡率为22.6%。然而,这一差异在统计上并不显著(P=0.72)。现时,并非所有有空气栓塞症的病人均会使用HAT治疗,因为必须评估使用高压氧的可能性,要考虑到使用高压氧可能带来的危害(交通工具和在HAT室的时间长度)[25-28]。
有证据表明,在明确诊断的情况下,必须强调的是,高压氧最好是在神经系统症状出现后的前四至六个小时内开始使用,同时也是在器官损伤、心肺或血流动力学损害的表现出现时开始使用高压氧治疗[29,30]。一旦确定有必要进行包括高压氧在内的明确治疗方案,就应加快进行这种治疗。一些研究表明,在最初事件发生后,高压氧治疗仍可发挥最多30小时的有益作用[31,32],但有些作者提出,并非所有的医生都热衷于对空气栓塞的高压氧治疗,尽管如果早期就开始使用HBT会有良好的疗效[33]。
尽管罕见,但由于其死亡率和发病率很高,医生必须能够识别和处理空气栓塞。在1970年代早期之前,创伤后的空气栓塞基本上没有得到确认;此后,发表了许多病例报告和系列报告。然而,现有文献的数量仍然很少;这可部分归因于诊断不足和误诊,因为大脑症状往往与其他原因有关[34-36]。及时识别、综合方案、补充氧气和理想的高压氧治疗在需要时提供最佳的生存机会。即使有适当的治疗,最近的数据显示,一年的总死亡率可能约为20%——这一发现与我们的研究相似,其中整个队列的死亡率为21% [5]。然而,需要注意的是,我们的研究针对的是那些经临床诊断或根据影像学诊断为空气栓塞的患者,这可能会优先识别更严重的空气栓塞病例。如上所述,由于没有临床体征和/或症状,可能有许多空气栓塞的病例未被发现。
5.结论
总之,大多数空气栓塞的病例是医源性的,最常见的是与侵入性医疗操作有关,而环境原因,如与创伤和潜水有关的原因,只占一小部分。空气栓塞后立即发生的心脏骤停与较高的死亡率相关。高度的临床怀疑,以允许早期识别和治疗是至关重要的。技术的进步和更新的指南建议,应该考虑使用呼末二氧化碳监测,即使是在接受手术的非插管患者中。据我们所知,预防空气栓塞的检查清单并不存在,尽管可能有证据支持可以使用[37]。强调了制定有效的预防和管理措施的重要性[38]。归根结底,至少应制定减少空气栓塞风险预案,实施标准化、工作人员培训和有针对性地备用具有抗栓塞安全功能的设备,至关重要[33,39]。

参考文献(略)
1. Mirski, M.A.; Lele, A.V.; Fitzsimmons, L.; Toung, T.J. Diagnosis and treatment of vascular air embolism. Anesthesiology 2007, 106, 164–177.
2. Muth, C.M.; Shank, E.S. Gas embolism. N. Engl. J. Med. 2000, 342, 476–482. 3. Pinho, J.; Amorim, J.M.; Araújo, J.M.; Vilaça, H.; Ribeiro, M.; Pereira, J.; Ferreira, C. Cerebral gas embolism associated with central venous catheter: Systematic review. J. Neurol. Sci. 2016, 362, 160–164.
4. Freund, M.C.; Petersen, J.; Goder, K.C.; Bunse, T.; Wiedermann, F.; Glodny, B. Systemic air embolism during percutaneous core needle biopsy of the lung: Frequency and risk factors. BMC Pulm. Med. 2012, 12, 2.
5. Bessereau, J.; Genotelle, N.; Chabbaut, C.; Huon, A.; Tabah, A.; Aboab, J.; Chevret, S.; Annane, D. Long-term outcome of iatrogenic gas embolism. Intensiv. Care Med. 2010, 36, 1180–1187.
6. Vesely, T.M. Air embolism during insertion of central venous catheters. J. Vasc. Interv. Radiol. 2001, 12, 1291–1295.
7. Wysoki, M.G.; Covey, A.; Pollak, J.; Rosenblatt, M.; Aruny, J.; Denbow, N. Evaluation of various maneuvers for prevention of air embolism during central venous catheter placement. J. Vasc. Interv. Radiol. 2001, 12,764–766.
8. Fisher, D.C.; Fisher, E.A.; Budd, J.H.; Rosen, S.E.; Goldman, M.E. The incidence of patent foramen ovale in 1000 consecutive patients. A contrast transesophageal echocardiography study. Chest 1995, 107, 1504–1509.
9. Orebaugh, S.L. Venous air embolism: Clinical and experimental considerations. Crit. Care Med. 1992, 20, 1169–1177.
10. Kapoor, T.; Gutierrez, G. Air embolism as a cause of the systemic inflammatory response syndrome: A case report. Crit. Care 2003, 7, R98–R100.
11. Flanagan, J.P.; Gradisar, I.A.; Gross, R.J.; Kelly, T.R. Air embolus—A lethal complication of subclavian venipuncture. N. Engl. J. Med. 1969, 281, 488–489.
12. Gale, T.; Leslie, K. Anaesthesia for neurosurgery in the sitting position. J. Clin. Neurosci. 2004, 11, 693–696.
13. Faberowski, L.W.; Black, S.; Mickle, J.P. Incidence of venous air embolism during craniectomy for craniosynostosis repair. Anesthesiology 2000, 92, 20–23.
14. Wong, B.; Zimmerman, D.; Reintjes, F.; Courtney, M.; Klarenbach, S.; Dowling, G.; Pauly, R.P. Procedure-related serious adverse events among home hemodialysis patients: A quality assurance perspective. Am. J. Kidney Dis. 2014, 63, 251–258. [CrossRef] [PubMed]
15. Roberts, S.; Johnson, M.; Davies, S. Near-fatal air embolism: Fibrin sheath as the portal of air entry. South. Med. J. 2003, 96, 1036–1038.
16. Tellides, G.; Ugurlu, B.S.; Kim, R.W.; Hammond, G.L. Pathogenesis of systemic air embolism during bronchoscopic Nd:YAG laser operations. Ann. Thorac. Surg. 1998, 65, 930–934.
17. Harrison, E.A.; Mackersie, A.; McEwan, A.; Facer, E. The sitting position for neurosurgery in children: A review of 16 years’ experience. Br. J. Anaesth. 2002, 88, 12–17.
18. Abu-Omar, Y.; Balacumaraswami, L.; Pigott, D.W.; Matthews, P.M.; Taggart, D.P. Solid and gaseous cerebral microembolization during off-pump, on-pump, and open cardiac surgery procedures. J. Thorac. Cardiovasc. Surg. 2004, 127, 1759–1765.
19.Baerlocher, M.O.; Nikolic, B.; Silberzweig, J.E.; Kinney, T.B.; Kuo, M.D.; Rose, S.C. Society of Interventional Radiology position statement on recent change to the ASA's moderate sedation standards: Capnography. J. Vasc. Interv. Radiol. 2013, 24, 939–940.
20. Weaver, J. The latest ASA mandate: CO2 monitoring for moderate and deep sedation. Anesth. Prog. 2011, 58, 111–112.
21. Beitz, A.; Riphaus, A.; Meining, A.; Kronshage, T.; Geist, C.; Wagenpfeil, S.; Weber, A.; Jung, A.; Bajbouj, M.; Pox, C.; et al. Capnographic monitoring reduces the incidence of arterial oxygen desaturation and hypoxemia during propofol sedation for colonoscopy: A randomized, controlled study (ColoCap Study). Am. J. Gastroenterol. 2012, 107, 1205–1212. [CrossRef] [PubMed]
22. Ahmad, K.; Asirvatham, S.; Kamath, S.; Peck, S.; Liu, X. Successful interventional management of catastrophic coronary arterial air embolism during atrial fibrillation ablation. Heart Rhythm Case Rep. 2016, 2, 153–156.
23. Durant, T.M.; Long, J.; Oppenheimer, M.J. Pulmonary (venous) air embolism. Am. Heart J. 1947, 33, 269–281.
24. Murphy, B.P.; Harford, F.J.; Cramer, F.S. Cerebral air embolism resulting from invasive medical procedures. Treatment with hyperbaric oxygen. Ann. Surg. 1985, 201, 242–245.
25.Brockmeyer, J.; Simon, T.; Seery, J.; Johnson, E.; Armstrong, P. Cerebral air embolism following removal of central venous catheter. Mil. Med. 2009, 174, 878–881.
26. Moon, R.; Butler, F.K. RE: Cerebral air embolism following removal of central venous catheter, published in [Mil Med 2009: 174(8): 878–881]. Mil. Med. 2010, 175, xvi.
27. McCrary, B.F. RE: Cerebral air embolism following removal of central venous catheter, published in [Mil Med 2009: 174(8): 878–881]. Mil. Med. 2009, 174, xii–xiii.
28. Brockmeyer, J.; Johnson, E.K. Cerebral air embolism following removal of central venous catheter. Mil. Med. 2011, 9, i.
29. Leach, R.M.; Rees, P.J.; Wilmshurst, P. Hyperbaric oxygen therapy. BMJ 1998, 317, 1140–1143.
30. Closon, M.; Vivier, E.; Breynaert, C.; Duperret, S.; Branche, P.; Coulon, A.; De La Roche, E.; Delafosse, B. Air embolism during an aircraft flight in a passenger with a pulmonary cyst: A favorable outcome with hyperbaric therapy. Anesthesiology 2004, 101, 539–542.
31. Blanc, P.; Boussuges, A.; Henriette, K.; Sainty, J.; Deleflie, M. Iatrogenic cerebral air embolism: Importance of an early hyperbaric oxygenation. Intensiv. Care Med. 2002, 28, 559–563.
32. Armon, C.; Deschamps, C.; Adkinson, C.; Fealey, R.D.; Orszulak, T.A. Hyperbaric treatment of cerebral air embolism sustained during an open-heart surgical procedure. Mayo Clin. Proc. 1991, 66, 565–571.
33. Bothma, P.A.; Schlimp, C.J., II. Retrograde cerebral venous gas embolism: Are we missing too many cases? Br. J. Anaesth. 2014, 112, 401–404.
34. Ho, A.M.; Ling, E. Systemic air embolism after lung trauma. Anesthesiology 1999, 90, 564–575.
35. Shaikh, N.; Ummunisa, F. Acute management of vascular air embolism. J. Emerg. Trauma Shock 2009, 2,180–185.
36. Ericsson, J.A.; Gottlieb, J.D.; Sweet, R.B. Closed-Chest Cardiac Massage in the Treatment of Venous Air Embolism. N. Engl. J. Med. 1964, 270, 1353–1354.
37. Ziewacz, J.E.; Arriaga, A.F.; Bader, A.M.; Berry, W.R.; Edmondson, L.; Wong, J.M.; Lipsitz, S.R.; Hepner, D.L.; Peyre, S.; Nelson, S.; et al. Crisis checklists for the operating room: Development and pilot testing. J. Am. Coll. Surg. 2011, 213, 212–217.e10.
38. McCarthy, C.J.; Behravesh, S.; Naidu, S.G.; Oklu, R. Air Embolism: Practical Tips for Prevention and Treatment. J. Clin. Med. 2016, 5, 93.
39. Feil, M. Preventing central line air embolism. Am. J. Nurs. 2015, 115, 64–69.